 02.10.2023
02.10.2023
GMP-инспекции производителей ветпрепаратов в третьем квартале 2023 года
С 1 сентября этого года вступили в силу изменения в Федеральный закон от 12.04.2010 г. № 61-ФЗ «Об обращении лекарственных средств», внесенные Федеральным законом от 02.07.2021 г. № 317-ФЗ [1]. В связи с этим ввод в гражданский оборот каждой серии ввозимого в Российскую Федерацию лекарственного препарата для ветеринарного применения должен осуществляться только при наличии заключения о соответствии производителя лекарственных средств требованиям Правил надлежащей производственной практики (Good Manufacturing Practice, GMP), выданного Россельхознадзором для каждой производственной площадки. В данном обзоре представлена информация по инспектированию производителей ветеринарных препаратов на соответствие требованиям Правил GMP, которое проводят специалисты Федерального государственного бюджетного учреждения «Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов» (ФГБУ «ВГНКИ»).
Результаты инспектирования
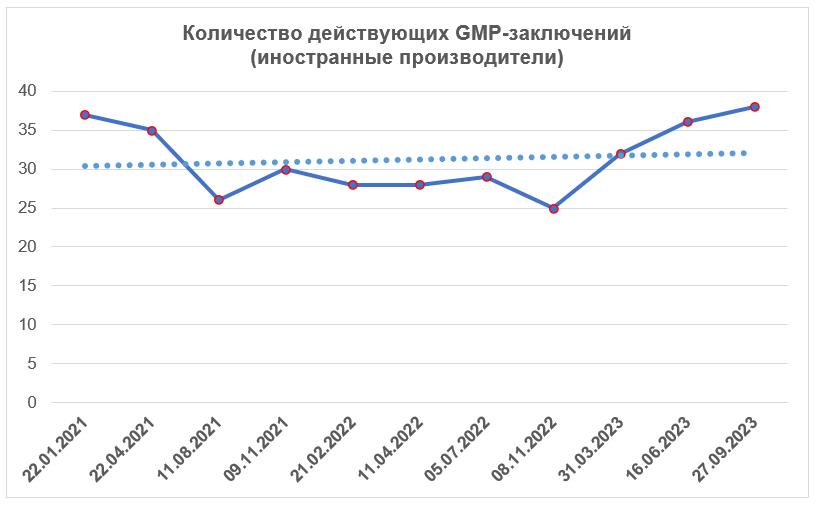
Иностранные производители
Согласно реестру заключений, опубликованному на сайте Россельхознадзора 27.09.2023 г. [2], в третьем квартале этого года было выдано 3 заключения о соответствии требованиям Правил GMP. Эти заключения были сделаны в отношении площадок, расположенных в Беларуси, Германии и Новой Зеландии.
К концу третьего квартала количество действующих GMP-заключений снова немного возросло.
На сегодняшний день зарубежные производители имеют 38 действующих GMP-заключений. Срок действия трех из этих заключений закончится до конца 2023 года.
По уточненным данным, в 2022 году процент отказов в выдаче GMP-заключений иностранным производителям лекарственных средств для ветеринарного применения составил 58%.
В прошлом году инспектора ФГБУ «ВГНКИ» провели 42 инспекциииностранных производителей. По итогам инспекций установлено, что 24производственные площадки не соответствуют требованиям Правил GMP, из них 13 площадок по выпуску фармакологических ветеринарных препаратов, 3 площадки по выпуску вакцин и 8 площадок по выпуску обоих видов лекарственных средств [3].
В соответствии с графиком проведения инспектирования, опубликованном на сайте ВГНКИ 19.09.2023 г. [4], на четвертый квартал 2023 годазапланировано 20 инспекций производителей ветеринарных препаратов, площадки которых расположены в Бразилии, Венгрии, Германии, Израиле, Испании, Китае, Нидерландах, Португалии, Румынии, США и Франции.
Российские производители
Согласно реестру на сайте Россельхознадзора [2], в третьем квартале текущего года было выдано GMP-заключение производственной площадке ООО «НПФ ВИК».
Группа компаний ВИК является не только крупнейшим ветеринарным производителем в СНГ, но и входит в 25 крупнейших ветеринарных фармацевтических компаний мира. Недавно исполнительный директор Группы компаний ВИК Сергей Каспарьянц рассказал съемочной группе телеканала НТВ о том, стоит ли опасаться сокращения ассортимента лекарственных препаратов для животных в ближайшее время: «С уверенностью могу сказать, что 99% ветеринарных фармацевтических препаратов за 1-2 года будут замещены на отечественные препараты, аналогичные по эффективности и безопасности» [5]
На сегодняшний день отечественные производители имеют 29 действующих заключений. Срок действия одного из этих заключений закончится до конца 2023 года.
Прошедшие события и мероприятия
В третьем квартале этого года прошло несколько мероприятий, которые могли бы быть полезными производителям для подготовки к инспектированию.
В июле в ФГБУ «ВГНКИ» состоялся курс повышения квалификации по подготовке лица, уполномоченного держателем или владельцем регистрационного удостоверения лекарственного препарата для ветеринарного применения [6]. В ходе обучения был рассмотрен широкий спектр вопросов:
- нормативная база и порядок ввода в гражданский оборот иммунобиологических и фармацевтических ветпрепаратов;
- полномочия федеральных органов исполнительной власти при обращении лекарственных средств для ветприменения;
- требования регистрационного досье;
- правила выдачи протоколов испытаний о соответствии серии иммунобиологического лекарственного препарата;
- основные требования, предъявляемые к уничтожению изъятых фальсифицированных, недоброкачественных и контрафактных лекарственных средств;
- методы отбора проб ветпрепаратов;
- управление персоналом;
- правила производства и контроля качества;
- претензии и отзыв продукции;
- помещения, инженерные системы и оборудование;
- общие принципы самоинспекции;
- корректирующие и предупреждающие действия.
По итогам прохождения аттестации слушатели могли получить удостоверения о повышении квалификации установленного образца.
В соответствии с вступившим в силу Приказом Минсельхоза России от 10.11.2022 г. № 795 [7], тестовые задания включают в себя пятьдесят вопросов, касающихся требований Правил GMP, а также требований к регистрационному досье на лекарственный препарат для ветеринарного применения.
В том же месяце в ФГБУ «ВГНКИ» состоялся семинар «Осуществление надлежащей дистрибьюторской практики лекарственных препаратов для ветеринарного применения (GDP)» [8].
Правила GDP лекарственных препаратов для ветеринарного применения вступили в силу 1 сентября этого года и будут действовать до 12 марта 2024 г. [9].
В июле в фонде «Центр стратегических разработок» (ЦСР) прошел круглый стол на тему «Эффекты регулирования ввода в оборот ветеринарных лекарственных средств». В ходе мероприятия были представлены результаты проведенного ЦСР исследования социально-экономических факторов обновления процедуры ввода в гражданский оборот ветеринарных лекарственных препаратов в Российской Федерации.
Составители анализа отметили, что к числу наиболее часто встречающихся нарушений, выявляемых по результатам инспекций, относятся в первую очередь несоответствия, связанные с отсутствием или неполнотой необходимой подтверждающей документации или с отсутствием на предприятии отдельных процедур контроля и верификации.
Наибольшая доля отказов в 2017-2023 годах происходила в результате несоответствия производителя ветеринарных лекарственных препаратов требованиям Правил GMP, при этом более 30% – в результате отказа от инспекции или неоплаты инспекции в срок.
В числе одной из ключевых сложностей представители производителей ветеринарных лекарственных препаратов также отмечали реализацию плана корректирующих и предупреждающих действий (CAPA-план) в установленный срок в 60 рабочих дней. Это связано как с тем, что отдельные несоответствия, связанные с ремонтом или переоборудованием производств, требуют большего времени на устранение, так и с тем, что при значимых изменениях в производственных процессах требуется согласование и учет этих изменений с регулирующими органами всех стран, на рынки которых поставляет свою продукцию производитель [10].
В августе на сайте ассоциации АВФАРМ была опубликована информация о том, что ООО «Эланко Рус» выходит из состава АВФАРМ [11]. Комментируя принятое решение, в Elanco добавили, что «внутренний фокус компании и ее российского представительства ООО «Эланко Рус» будет направлен на совершенствование производственных площадок и приведение их в соответствие с требованиями российского регулятора».
В сентябре в Москве прошел 2-й Китайско-Российский форум по биофармацевтическим технологиям и деловому сотрудничеству. Организаторами мероприятия выступили компании Chengdu Yingde Biological Pharmaceutical Equipment Co., Ltd. и SinoPharmtech. Основной целью форума является развитие взаимовыгодного партнерства между Россией и Китаем в сферах биофармацевтики и трансфера технологий. Свои кейсы представили лидеры биофармацевтического рынка Китая, в том числе компания Pulike Biological Engineering, которая в основном занимается исследованиями и разработками, производством и маркетингом ветеринарных биологических продуктов [12].

Напомним, что в прошлом году в Китае были внедрены новые требования стандарта GMP на предприятиях, работающих в сфере производства лекарственных средств для ветеринарного применения. Все предприятия, не прошедшие проверку до 1 июня 2022 года, должны были приостановить производство ветеринарных препаратов до получения подтверждения соответствующим требованиям [13].
По результатам проведенных в 2018-2022 годах российских инспекций, расположенные в Китае производственные площадки производителей ветеринарных препаратов получили менее 30% отказов в выдаче заключений, что является достаточно хорошим показателем.

В сентябре в Екатеринбурге прошла VIII Всероссийская GMP-конференция с международным участием, организованная Минпромторгом России совместно с ФБУ «ГИЛС и НП». Девиз GMP конференции в этом году – «GMP: надлежащее качество в современных условиях». Директор ФБУ «ГИЛС и НП» Владислав Шестаков обратил внимание, что этот слоган отражает актуальную для участников фармотрасли повестку: «Надлежащее качество в производстве лекарственных препаратов – это залог безопасности граждан нашей страны. А соблюдение регуляторных, производственных требований и стандартов в современных условиях дает нам возможность двигаться в сторону импортозамещения, а также активного развития экспорта на новые и перспективные для нас регионы. В условиях многополярного мира, который формируется на протяжении последних лет, мы остаемся открыты для межстранового и международного сотрудничества» [14].
Ближайшие события и мероприятия
3 октября компания ФАРМСТРАТЕГИЯ проведет мастер-класс по теме «Актуальные вопросы инспектирования производства стерильных лекарственных средств. Взгляд инспектора» [15]. Ключевые темы и понятия:
- инспектирование производства стерильных лекарственных средств;
- Приложение 1 GMP ЕАЭС [16];
- оценка рисков для качества;
- выявляемые несоответствия.
До 10 октября на платформе Евразийской академии надлежащих практик проходит очередной курс повышения квалификации «Подготовка аудиторов производства лекарственных средств» (заочная форма обучения с использованием дистанционных образовательных технологий). По окончании обучения слушателям выдается удостоверение о повышении квалификации установленного образца [17].
20 октября в Москве пройдет V Международная конференция «Логистика лекарственных средств» [18]. На конференции состоится объявление результатов голосования 339 экспертов жюри Премии SCM Pharm 2023, участники получат Сборник практических статей GDP Review 4.
В частности, в рамках конференции состоится интерактивная дискуссия «Цифровая трансформация процессов по валидации и квалификации – как часть концепции Pharma 4.0™». Модераторами дискуссии будут Оксана Пряничникова – Генеральный директор PQE CIS, заместитель директора ISPE ЕАЭС и Александр Белинский – технический директор PQE CIS, участник Рабочей Группы ISPE ЕАЭС.
24-26 октября в Москве пройдет ежегодная Евразийская конференция по валидации. Это мероприятие с образовательным потенциалом, направленное на обсуждение актуальных теоретических и практических вопросов в области анализа рисков, квалификации и валидации для подтверждения надлежащих практик [19].
Новые вызовы в рамках ЕАЭС
Менее чем через полгода вступят в силу новые «Правила регулирования обращения ветеринарных лекарственных средств на таможенной территории ЕАЭС», утвержденные Решением Совета ЕЭК от 21.01.2022 г. № 1 [20]. Приложение №26 к ним – Правила проведения фармацевтических инспекций – устанавливают единый порядок проведения фармацевтических инспекций производства ветеринарных лекарственных средств на соответствие требованиям Правил GMP ЕАЭС. Согласно текущей редакции документа:
- В случае если при проведении инспекции были выявлены несоответствия, ответ с приложением плана корректирующих и предупреждающих действий (CAPA-плана) и отчета о его выполнении с материалами, подтверждающими факт их выполнения, должен быть направлен в уполномоченный орган, организовавший инспекцию, не позднее 30 календарных дней со дня получения инспекционного отчета
- GMP-сертификат выдается уполномоченным органом при условии устранения субъектом в сфере обращения ветеринарных лекарственных средств всех критических и существенных несоответствий, а также прочих несоответствий, если в совокупности они представляют собой существенные несоответствия
- Порядок проведения фармацевтической инспекции с использованием средств дистанционного взаимодействия (дистанционное инспектирование) в Правилах пока не описан.
Следует отметить, что августе этого года сотрудники ФГБУ «ВГНКИ» провели курс повышения квалификации для специалистов Национального референтного центра по ветеринарии Комитета ветеринарного контроля и надзора Министерства сельского хозяйства Республики Казахстан. Программа курса была посвящена организации производства и контроля качества лекарственных средств для ветеринарного применения [21].
Производителям рекомендуется принимать активное участие в событиях и мероприятиях, связанных с GM(D)P, и тщательнее готовиться к инспектированию.
Теги: ветеринария, ветпрепараты
Количество показов: 12311
Источник: https://pharmprom.ru/gmp-inspekcii-proizvoditelej-vetpreparatov-v-tretem-kvartale-2023-goda/
Материалы по теме:
- О будущем рынка ветеринарной фармацевтики и стратегических направлениях деятельности ГК ВИК рассказал исполнительный директор компании
- Минсельхоз предложил расширить перечень получающих господдержку производителей ветпрепаратов
- Доля российских вакцин для животных на отечественном рынке выросла до 65% — Россельхознадзор
- ГК ВИК представляет новое направление деятельности – производство вакцин
- Аргентина начнет поставки вакцин для животных в РФ
















