 10.01.2024
10.01.2024
GMP-инспекции производителей ветпрепаратов в четвертом квартале 2023 года
В данном обзоре представлена информация по инспектированию производителей ветеринарных препаратов на соответствие требованиям Правил надлежащей производственной практики (Good Manufacturing Practice, GMP), которое проводят специалисты Федерального государственного бюджетного учреждения «Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов» (ФГБУ «ВГНКИ»).
Результаты инспектирования
Иностранные производители
Согласно реестру заключений, опубликованному на сайте Россельхознадзора 18.12.2023 г. [1], в четвертом квартале этого года было выдано 5 заключений о соответствии требованиям Правил GMP. Эти заключения были сделаны в отношении площадок, расположенных в Греции, Израиле, Италии и США.Таким образом, в 2023 году иностранным производителям было выдано уже 20 заключений, что в 2 раза больше, чем в предыдущем году.
Наибольшее число российских инспекций, по результатам которых за 2017-2023 годы были приняты решения о выдаче/отказе в выдаче GMP-заключения, проведено на производственных площадках, расположенных в Испании (31, что составляет 15%). Также много инспекций было проведено на площадках, расположенных во Франции (28, что составляет 14%).
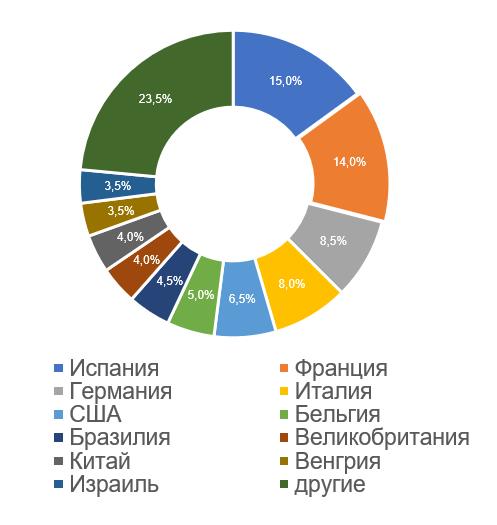
Анализ результатов инспектирования в тех странах, где было проведено наибольшее число российских инспекций, показывает следующие тренды:
- худшие результаты у производственных площадок, расположенных в США, Бразилии и Германии (более 80% отказов в выдаче заключения);
- лучшие результаты у производственных площадок, расположенных в Израиле и Словении(ни одного отказа в выдаче заключения).
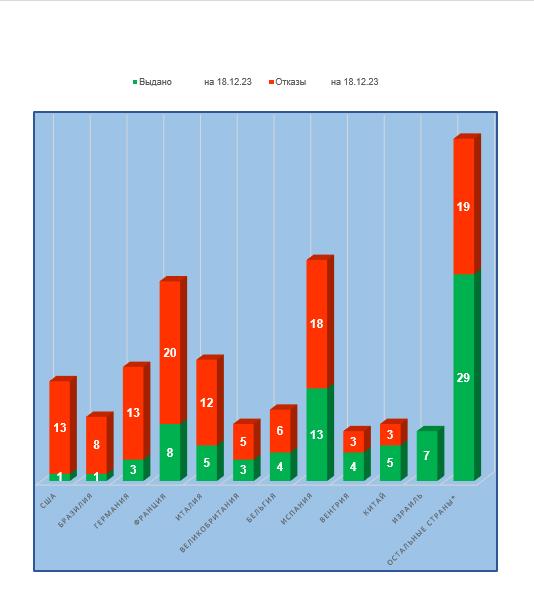
В четвертом квартале этого года, впервые за все годы инспектирования, российское GMP-заключение смогла получить производственная площадка из США.
По данным анализа розничных продаж ветеринарных препаратов в России с января по сентябрь 2023 года, который был проведен компанией RNC Pharma [2], США в рейтинге стран-поставщиков по-прежнему сохраняют второе место с показателем 33,6%.
Напомним, что в сентябре этого года вступили в силу изменения в Федеральный закон от 12.04.2010 г. № 61-ФЗ «Об обращении лекарственных средств», внесенные Федеральным законом от 02.07.2021 г. № 317-ФЗ [3]. В соответствии с этими изменениями ввод в гражданский оборот каждой серии ввозимого в Российскую Федерацию лекарственного препаратадля ветеринарного применения должен осуществляться только при наличии заключения о соответствии производителя лекарственных средств требованиям Правил GMP, выданного Россельхознадзором для каждой производственной площадки.
Результаты инспектирования производственных площадок, расположенных в Венгрии и Китае, несколько ухудшились – процент отказов увеличился до 43% и 38% соответственно. Такая ситуация не может не беспокоить производителей ветеринарных препаратов в этих странах.
В октябре этого года во время III Международного форума «Один пояс – один путь» в Пекине президент РФ Владимир Путин провел незапланированную встречу с премьер-министром Венгрии Виктором Орбаном. «Несмотря на то что в сегодняшних геополитических условиях возможности для поддержания контактов и развития отношений весьма ограничены, тем не менее не может не вызывать удовлетворения, что со многими странами Европы у нас отношения сохраняются, развиваются. Одна из этих стран – Венгрия», – сказал президент [4]. После церемонии открытия форума в Пекине также прошли российско-китайские переговоры. Председатель КНР Си Цзиньпин заявил [5], что товарооборот России и Китая продолжает расти – он достиг исторического рекорда и теперь стремится к сумме в $200 млрд.
Поддержание хороших экономических отношений с этими странами отвечает интересам России. Например, в этом году были новости о том, что венгерская компания рассматривает Татарстан для открытия завода по производству флаконов [6], а китайский инвестор будет производить в Воскресенске фармацевтическую субстанцию [7].
Российский рынок ветеринарных препаратов также очень интересен венгерским и китайским партнерам, которые стараются сохранить экономические связи с Россией. Несмотря на то, что в этих и других странах действуют свои Правила GMP, производители продолжают детально изучать требования Правил GMP ЕАЭС [8] и готовиться к инспектированию своих площадок, поэтому сохраняется надежда на улучшение результатов инспектирования.
О требованиях GMP и фармакопеи для ветеринарных препаратов в Китае можно прочитать здесь: https://pharmprom.ru/trebovaniya-gmp-i-farmakopei-dlya-veterinarnyx-preparatov-v-kitae/
Следует отметить, что результаты ряда инспекций, проведенных во втором полугодии, могут стать известны только в первой половине 2024 года, поэтому итоги этого года еще могут измениться.
По информации ФГБУ «ВГНКИ» [9], в 2023 году Органом инспекции было проведено 50 инспектирований иностранных производителей лекарственных средств на соответствие требованиям Правил GMP, 24 из которых прошли в дистанционном формате. Кроме того, были произведены процедуры по оценке представленных планов корректирующих и предупреждающих действий (CAPA-планов) и документов, подтверждающих выполнение устранения несоответствий по результатам инспекций.
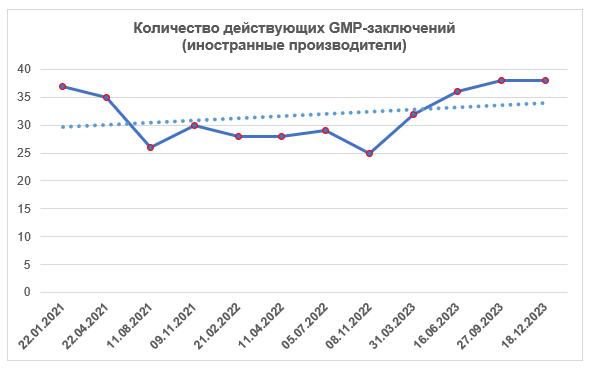
Согласно реестру [1], к концу четвертого квартала количество действующих GMP-заключений не изменилось. На сегодняшний день зарубежные производители имеют 38 действующих GMP-заключений. В течение последних трех лет число этих заключений находится примерно на одном и том же уровне, a в этом году постепенно возрастало.
Наибольшее число действующих заключений сейчас имеют израильские, испанские и китайские площадки.
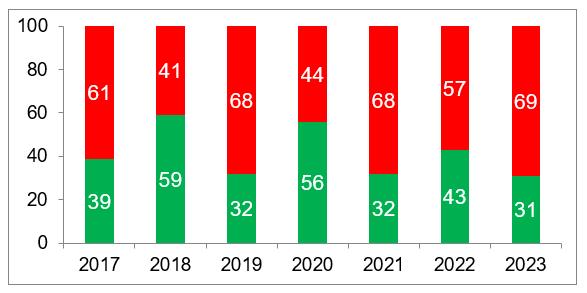
По имеющимся на сегодняшний день данным, в 2023 году процент отказов в выдаче GMP-заключенийиностранным производителям был выше, чем в предыдущем году – 69%. При этом средний процент отказов за все годы инспектирования повысился до 59% (по повторным инспекциям он составляет 67%, по третьим инспекциям – 70%). Также довольно высоким является средний процент отказов по инспекциям, связанным с обновлением ранее выданных GMP-заключений – 58%.
В соответствии с графиком проведения инспектирования, опубликованном на сайте ВГНКИ 07.12.2023 г. [10], на первое полугодие 2024 года уже запланировано 12 инспекций производителей ветеринарных препаратов, площадки которых расположены в Аргентине, Германии, Индии, Корее, Турции и Франции.
Российские производители
В последней версии реестра на сайте Россельхознадзора [1] нет данных о выдаче GMP-заключений площадкам отечественных производителей в четвертом квартале.
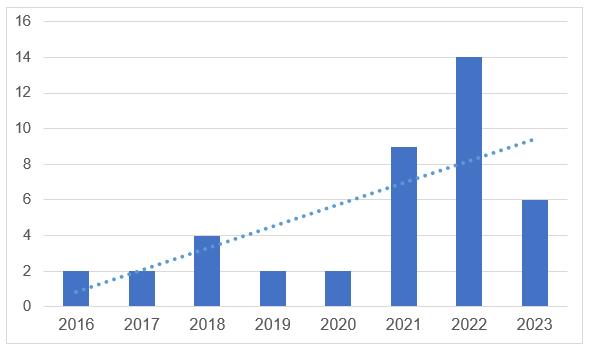
Согласно реестру, в целом за 2023 год российским производителям было выдано 6 заключений. На сегодняшний день отечественные производители имеют 28 действующих заключений.
Напомним, что по результатам периодического подтверждения соответствия возможно получение заключения о соответствии требованиям Правил GMP.
По информации Минсельхоза, сейчас в России 99российских производителей ветеринарных препаратов соответствуют требованиям GMP (13% – государственные организации, 87% – коммерческие). Всего в РФ зарегистрировано 2262 ветеринарных препарата, в том числе 1387 – отечественного производства (61,3%) [11].
В рамках импортозамещения российские производители зарегистрировали в 2023 году 30ветеринарных вакцин и 81 фармацевтический препарат для животных, сообщили федеральному отраслевому изданию «Ветеринария и жизнь» в пресс-службе Россельхознадзора [12].
Российские компании, выпускающие ветеринарные препараты, намерены в ближайшее время увеличить производственные мощности на 40-60%. Об этом на XV Международной научно-практической конференции «Свиноводство-2023» рассказал исполнительный директор Национальной ветеринарной ассоциации (НВА) Тимур Чибиляев[13].
Прошедшие события и мероприятия
В четвертом квартале этого года прошло несколько событий и мероприятий, которые могли бы быть полезными производителям для подготовки к инспектированию.
20 октября вступило в силу Решение Совета ЕЭК от 27 сентября 2023 года № 101 «О внесении изменений в Решение Совета Евразийской экономической комиссии от 21 января 2022 г. № 1»[14]. Принятое Решение Совета ЕЭК гарантирует взаимное признание сертификатов GMP Евразийского экономического союза.
Недавно Россельхознадзор опубликовал на своем сайте список производителей лекарственных препаратов для ветеринарного применения Республики Беларусь, имеющих соответствующий сертификат GMP [15].
В октябре этого года в Москве прошла V Международная конференция «Логистика лекарственных средств» [16]. Всем участникам конференции сообщество руководителей и специалистов по логистике и качеству SCM Pharm подарило Сборник практических статей GDP Review 4.
Среди представленных в сборнике материалов можно отметить статью «К вопросу квалификации машин»(доценты кафедры промышленной фармации Сеченовского университета Сергей Грейбо, Василий Беляев и Наталья Николенко) [17]. В этой статье речь идет о квалификации машин транспортной компании, которая специализируется на перевозке лекарственных средств. Авторы статьи отмечают, что транспортирование является одним из самых малоизученных вопросов обращения лекарственных средств.
В соответствии с требованиями Правил надлежащей дистрибьюторской практики лекарственных препаратов для ветеринарного применения [18], которые в России вступили в силу в сентябре 2023 года, в процессе перевозки препаратов должны обеспечиваться условия хранения, предусмотренные инструкцией по их применению.
В октябре в рамках Международной специализированной выставки кормов, кормовых добавок, ветеринарии и оборудования «КормВет-2023» состоялся круглый стол на тему «Перспективы развития ветеринарной отрасли». В ходе мероприятия спикеры обсудили вопросы порядка ввода лекарственных препаратов в гражданский оборот, специфики проведения инспектирования иностранных производителей лекарственных средств для ветеринарного применения, а также внедрения средств специфической профилактики болезней животных в рамках стратегии импортозамещения.
В частности, заместитель директора ФГБУ «ВГНКИ» Данил Рудняев рассказал об особенностях проведения инспектирования иностранных производителей лекарственных средств для ветеринарного применения [19]:
- Все коммуникации с заявителями при подготовке к инспектированию теперь будут осуществлять не инспектора, а Отдел международного сотрудничества ФГБУ «ВГНКИ» (при подготовке документов для проведения инспектирования: подготовка, согласование, публикация графиков инспекций; подготовка и передача документов по инспектированию представителю площадки; бронирование гостиницы и подготовка маршрутов; при инспектировании: проверка резюме и собеседование с переводчиками; переводческое сопровождение инспекции; передача инспекционного отчета представителю площадки; при оценке документов САРА: подготовка и согласование дополнительного соглашения; передача документов представителю площадки)
- Помимо тех переводчиков, которых предоставляет заявитель, в инспекции должен будет принять участие отдельный переводчик от ФГБУ «ВГНКИ», услуги которого будет оплачивать заявитель
- В случае, если у инспекторов возникнут сложности с прохождением границы в странах ЕС (например, в их отношении будут предприняты попытки забрать их телефоны или ноутбуки), инспектора вернутся обратно, инспекция будет отменена, и ее стоимость не будет возвращена заявителю.

На сайте ФГБУ «ВГНКИ» в разделе «Отдел инспекции производства на соответствие требованиям надлежащей производственной практики» (подраздел «Полезная информация») была размещена Форма типового соглашения (договора), заключаемого с уполномоченными представителями иностранных производителей лекарственных средств для ветеринарного применения [20, 21], в которой были обновлены положения, касающиеся услуги перевода с языка страны заявителя или иного иностранного языка на русский язык во время проведения инспектирования. ФГБУ «ВГНКИ» оставляет за собой право в одностороннем порядке принимать решение о компетентности и утверждении переводчиков, планируемых к привлечению в части оказания услуг устного и письменного перевода при инспектировании.
Вопросам перевода посвящена статья руководителя компании GMP-inspection.com Александра Подаревского «Переводчики на GMP-инспекциях: сложности и «анализ рисков», которая была опубликована во втором номере отраслевого журнала «ФАРМПРОМ» за 2023 год в формате онлайн [22]. Автор рассказывает о том, на что следует обращать внимание при выборе профессиональных переводчиков с опытом сопровождения GMP-инспекций и знанием фармацевтической терминологии.
В ноябре состоялась пресс-конференция ТАСС, посвященная подведению итогов международного конкурса «GxP-Профи 2023» [23].
На этой пресс-конференции исполнительный директор департамента технического регулирования и аккредитации ЕЭК Чинара Мамбеталиева сообщила: «В ближайших планах комиссии – подготовка обновления разделов Правил GMP ЕАЭС. Мы планируем ввести раздел по организации производства высокотехнологичных лекарственных препаратов, а также актуализировать производство стерильных лекарственных препаратов».
В декабре в Учебном Центре «ДжиЭксПи» прошел Форум специалистов по валидации [24]. Мероприятие собрало специалистов из различных отраслей фармацевтической промышленности, занятых в процессах валидации. Форум стал уникальной площадкой для обмена опытом, обсуждения актуальных вопросов и трендов в области валидации, а также для поиска новых идей и решений.
В том же месяце на площадке завода «НТФФ «Полисан» в Санкт-Петербурге эксперты фармацевтической отрасли собрались на профильный воркшоп, организованный Евразийским отделением ISPE (ISPE ЕАЭС). Темой обсуждения стала тематикауправления знаниями на фармацевтическом производстве.
В частности, на этом мероприятии директор по качеству НТФФ «Полисан» Светлана Скорикрассказала об управлении знаниями при организации трансфера продуктов и технологии. На основе опыта компании «Полисан» она дала пошаговую оценку системы управления знаниями, показав, как имеющийся опыт и знания компании на каждом из временных отрезков позволяли осуществлять успешный трансфер продуктов и технологий, а также поделилась со слушателями практическим опытом преодоления технологических и организационных сложностей, сопутствующих процессам трансфера [25].
Оксана Пряничникова, заместитель директора ISPE ЕАЭС и Генеральный директор компании PQE CIS, выразила благодарность производителю «Полисан» за открытость к инновационному формату и всем докладчикам, которые предоставили отличное введение и передовой опыт, основанный на Руководстве ISPE «Управление знаниями в фармацевтической промышленности» (ISPE Good Practice Guide: Knowledge Management in the Pharmaceutical Industry) [26].
Производителям рекомендуется принимать активное участие в событиях и мероприятиях, связанных с GM(D)P, и тщательнее готовиться к инспектированию.
Представленный материал подготовлен с использованием данных, актуальных на 24.12.2023 г. В случае получения новых или дополнительных данных статья может быть обновлена.
Константин Морозов, специалист по GMP, аудитор фармацевтических предприятий
Федеральное государственное бюджетное учреждение «Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов», ФГБУ «ВГНКИ» – учреждение, уполномоченное на проведение инспектирования производителей лекарственных средств для ветеринарного применения, производство которых осуществляется за пределами Российской Федерации, на соответствие требованиям Правил GMP
Национальная ветеринарная ассоциация, НВА – некоммерческая организация, которая является коллаборацией ключевых биофармацевтических компаний
Евразийское отделение ISPE, ISPE ЕАЭС – локальное отделение ISPE в Евразийском экономическом союзе, созданное для экспертной поддержки развития надлежащих практик в фармацевтической отрасли на территории ЕАЭС
Теги: ветеринария, ветпрепараты, gmp инспекции
Количество показов: 10948
Источник: https://pharmprom.ru/gmp-inspekcii-proizvoditelej-vetpreparatov-v-chetvertom-kvartale-2023-goda/
Материалы по теме:
- О будущем рынка ветеринарной фармацевтики и стратегических направлениях деятельности ГК ВИК рассказал исполнительный директор компании
- Минсельхоз предложил расширить перечень получающих господдержку производителей ветпрепаратов
- Доля российских вакцин для животных на отечественном рынке выросла до 65% — Россельхознадзор
- ГК ВИК представляет новое направление деятельности – производство вакцин
- Аргентина начнет поставки вакцин для животных в РФ

















